Clo là một trong những nguyên tố phi kim nằm trong bảng tuần hoàn hóa học. Nó được ứng dụng vô cùng rộng rãi trong nhiều lĩnh vực hàng ngày. Cụ thể thì Clo có những tính chất gì? Làm sao điều chế clo trong phòng thí nghiệm? Tất cả được chúng tôi giải đáp ở bài viết dưới đây.
Nội dung bài viết
Clo là chất gì? Tính chất vật lý & tính chất hóa học của Clo
Clo là một nguyên tố phi kim và thuộc nhóm halogen trong bảng tuần hoàn các nguyên tố hóa học. Ký hiệu hóa học của nó là Cl, thuộc ô 17, chu kỳ 3, số nguyên tử là 17. Clo là nguyên tố có áp lực điện tử cao nhất, độ âm điện đứng thứ 3.
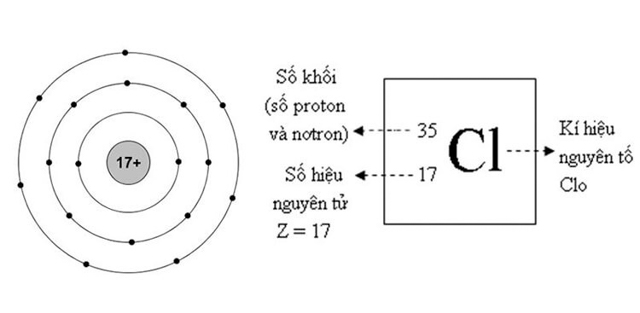
Cấu tạo nguyên tử của Clo
Cấu hình electron của Clo: [Ne] 3s2 3p5. Mỗi lớp chứa 2 7 8 e. Khối lượng nguyên tử của Clo là: 453 g.
Đây là một nguyên tố quan trọng, là thành phần của muối ăn chúng ta sử dụng hàng ngày (Natri Clorua) và nhiều hợp chất khác phục vụ cuộc sống của con người. Trong tự nhiên, Clo chiếm tới 1,94%. Muối biển Natri Clorua ở trạng thái rắn gọi là muoosimor. Các khoáng vật có chứa clo gồm: cacnalit KCl.MgCl2.6H2O và xinvinit NaCl.KCl.
Tính chất vật lý của Clo

Clo là chất khí màu vàng nhạt
Bình thường, khí clo sẽ có màu vàng nhạt, khi ngửi thấy có mùi hắc và khó thở, có tính chất oxi hóa cực mạnh, dễ phản ứng với nhiều kim loại hoặc phi kim khác nhau.
Clo có dvC nặng hơn không khí rất nhiều, có thể nhanh chóng tan trong nước tạo ra dung dịch cũng có màu vàng nhạt gồm có: HCl, HClO. Trong các môi trường dung môi hữu cơ, clo tan được nhiều hơn.
Tính chất hóa học của clo
Clo là một trong những phi kim điển hình, có tính oxi hóa mạnh, lớp ngoài cùng có 7e nên rất dễ nhận thêm e.
Cl2 + 2e → 2Cl– (ion clorua)
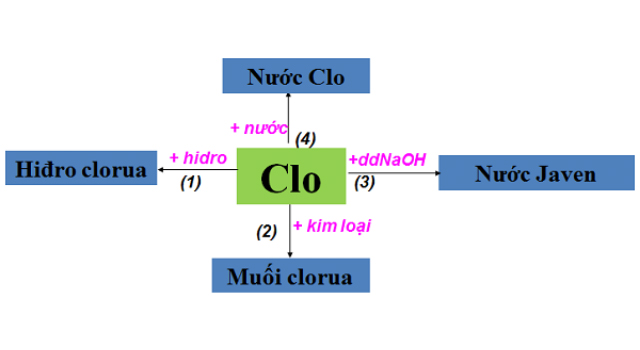
Tính chất hóa học nổi bật của khí Clo
Khi ở trạng thái hợp chất, Clo thường có mức oxi hóa là -1. Trường hợp đặc biệt, kết hợp với các phi kim có độ oxy hóa mạnh hơn như F hoặc O, clo sẽ có mức oxi hóa là +1; +3; +5; +7.
Tác dụng với kim loại: Clo phản ứng với hầu hết các kim loại để tạo ra muối Clorua (trừ Au, Pt).
Ví dụ Clo phản ứng với Sắt: 2Fe + 3Cl2 → 2FeCl3
Ví dụ Clo phản ứng với Kẽm: 2Zn + Cl2 → 2ZnCl2
Tác dụng với hiđro: Clo phản ứng với Hidro ngay ở điều kiện thường, có ánh sáng chiếu vào để tạo ra axit nồng độ nhẹ. Phản ứng khi tạo thành sẽ là một hỗn hợp nổ khá nguy hiểm.
Ví dụ Clo phản ứng với Hidro: H2 + Cl2 → 2HCl
Tác dụng với nước: Khi sục khí Clo vào nước sẽ xảy ra phương trình thuận nghịch. Dung dịch nước sau khi sục khí Clo có tính oxi hóa rất mạnh, được sử dụng làm chất tẩy màu, khử khuẩn.
Tác dụng với dung dịch muối: Tác dụng với muối của các nguyên tố trong nhóm halogen yếu hơn để tạo ra muối mới và phi kim mới.
Ví dụ:
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2KI → 2KCl + I2
Ngoài ra Clo còn tác dụng với các hợp chất có tính khử cao như:
2FeCl2 + Cl2 → 2FeCl3
3Cl2 + 2NH3 → N2 + 6HCl
Khí clo là một loại khí cực độc, ảnh hưởng trực tiếp tới hệ hô hấp của con người nếu hít phải. Vì thế, để làm giải độc tố của khí Clo, người ta thường sử dụng Amoniac để trung hòa, hoặc các dung dịch axit nhẹ.
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
||Xem thêm: Kim Loại Là Gì? Tính Chất Hóa Học Chung Của Kim Loại
Cách điều chế clo trong phòng thí nghiệm chuẩn

Điều chế Clo trong thí nghiệm cần cẩn thận và tỉ mỉ
Khí clo mặc dù rất độc hại nhưng vẫn được nghiên cứu và ứng dụng vào thực tiễn cuộc sống, giúp ích trong rất nhiều lĩnh vực. Vậy trong phòng thí nghiệm, khí clo được điều chế bằng cách nào?
Phương pháp điều chế clo trong phòng thí nghiệm là chúng ta sẽ sử dụng axit clohidric đặc và cho tác dụng với một chất oxi hóa mạnh. Thông thường sẽ là hợp chất kali pemanganat rắn hoặc mangan dioxit rắn. Dùng mangan dioxit rắn thì khi xây dựng thí nghiệm cần có thêm yếu tố xúc tác là nhiệt độ.
Sau khi phản ứng xảy ra chúng ta sẽ thu được hỗn hợp khí có lẫn hơi nước, HCl. Để loại bỏ HCl, chúng ta sẽ dẫn hỗn hợp khí đi qua dung dịch có NaCl. Để loại bỏ H2O chúng ta sẽ dẫn hỗn hợp khí đi qua dung dịch H2SO4 đặc. Nguyên tắc điều chế clo trong phòng thí nghiệm là khi đầu ra, ống sẽ bị kín bằng bông tẩm xút để tránh khí Clo phát tán ra ngoài ảnh hưởng tới hệ hô hấp của con người.
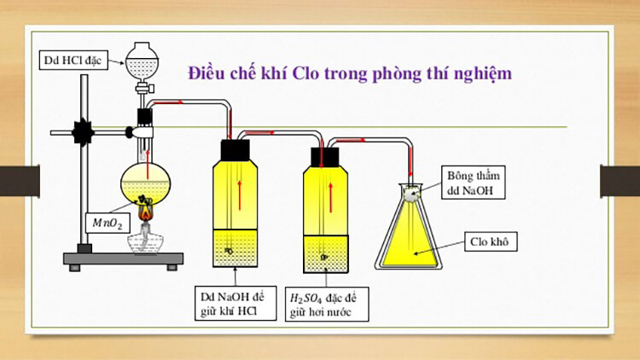
Sơ đồ điều chế clo trong phòng thí nghiệm
Các phương trình hóa học xảy ra trong phản ứng điều chế clo trong phòng thí nghiệm như sau:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
KClO3 + 6 HCl → KCl + 3 H2O + 3Cl2
CaOCl2 + 2HCl → Cl2 + CaCl2 + H2O
Ngoài điều chế nghiên cứu trong phòng thí nghiệm, để điều chế khí Clo với lượng lớn, nhanh chóng, tiết kiệm chi phí thì người ta sử dụng cách điều chế công nghiệp: điện phân nóng chảy muối Natri clorua theo phương trình:
2NaCl → 2Na + Cl2
Hoặc điện phân dung dịch muối Natri clorua theo phương trình:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
Clo có tính ứng dụng như thế nào trong thực tiễn cuộc sống?

Clo có rất nhiều ứng dụng thực tiễn
Khí Clo được biết đến là một trong những hóa chất có tính thực tiễn cao. Ngoài tác dụng tẩy trắng, khử trùng như ở trên thì nó còn ứng dụng rất nhiều trong các lĩnh vực khác như:
- Sử dụng là nguyên liệu trong sản xuất các loại muối kích thích hệ tiêu hóa
- Sử dụng trong công nghiệp, làm sạch bể bơi
- Sử dụng dẫn khí clo một lượng vừa đủ giúp cơ thể con người an thần hơn
||Xem thêm: Cách điều chế Hidro trong phòng thí nghiệm, Phương trình
Mỗi loại chất khác nhau lại có những tác dụng khác nhau trong cuộc sống. Khi nghiên cứu ra, con người sẽ tìm cách sử dụng chúng sao cho hợp lý nhất. Với các thông tin trên, bạn đã hiểu và nắm được cách điều chế clo trong phòng thí nghiệm cụ thể chưa? Đây là một trong những kiến thức quan trọng ở phần Halogen bạn cần nắm được, nó xuất hiện trong rất nhiều đề thi và là kiến thức căn bản để bạn học tốt môn Hóa học đó.
||Bài viết liên quan khác:










