Javen là một trong những loại nước tẩy phổ biến, ứng dụng trong rất nhiều lĩnh vực khác nhau. Nhưng bạn đã bao giờ đặt ra thắc thắc rằng làm sao để điều chế nước Javen trong phòng thí nghiệm? Có những cách nào điều chế loại nước này với chi phí rẻ nhất không? Tất cả sẽ được chúng tôi tổng hợp và gửi tới bạn ở bài viết sau.
Nội dung bài viết
Nước javen là gì? Các tính chất vật lý của nước javen (Natri hypochlorite)
Trước khi tìm hiểu cách điều chế nước javen trong phòng thí nghiệm thì chúng ta cần phải nắm được các tính chất cơ bản của loại nước này. Cụ thể:
Nước javen trong khoa học được gọi là Sodium hypochlorite với công thức hóa học là NaOCl. Trong thành phần hỗn hợp Javen gồm có các thành phần chính là muối Nacl và NaClO (NaClO chiếm tỷ lệ chính). Nhờ có thành phần gốc (O) có tính chất oxy hóa cao nên hợp chất này có tính tẩy cực kỳ mạnh.

Nước javen (Natri hypochlorite) có màu vàng nhạt, tính tẩy cực mạnh
Dung dịch nước javen ở nhiệt độ thường sẽ có màu vàng. Nếu javen được cô đặc ở dạng bột thì nó sẽ có màu trắng. Khi ngửi mùi, bạn sẽ cảm thấy javen có mùi rất hắc và khó chịu, đây là mùi của khí clo còn lẫn và do tiếp xúc với không khí nó bị phân hủy.
Nước gia ven là loại dung dịch được cảnh báo có độc tính cao, ảnh hưởng trực tiếp tới sức khỏe con người khi hít phải hoặc tiếp xúc trực tiếp với da. Chính vì vậy, khi sử dụng nước javen bạn cần phải mang đầy đủ các trang thiết bị bảo hộ và sử dụng đúng cách.
Mang đồ bảo hộ cẩn thận khi tiếp xúc với nước Javen
Các thông tin về tính chất vật lý của Javen:
- Khối lượng mol: 74,44 g/mol.
- Công thức phân tử: NaClO
- Nhiệt độ nóng chảy:18°C
- Nhiệt độ sôi: 102,2°C
- Tỷ trọng: 1,2
- Điều kiện bảo quản: 2°C – 8°C
- Mật độ: 1,11 g/Ml
Các tính chất hóa học của nước Javen (Natri hypochlorite)
Javen (Natri hypochlorite) là một chất được đánh giá có tính oxy hóa cực mạnh, nó phản ứng với hầu hết các loại axit và sinh ra khí Clo rất độc hại.
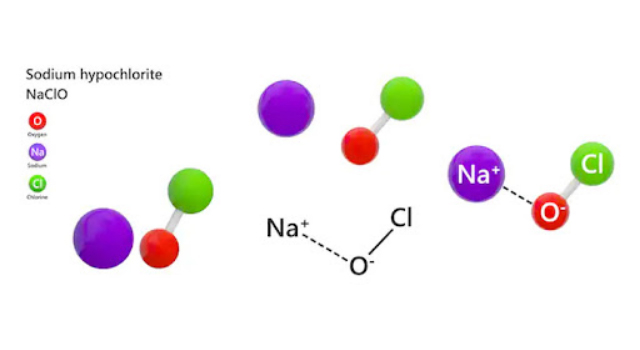
Dạng phân tử của Javen (NaClO)
Sau phản ứng, nó thường tại thành axit mới, axit hypochlorous (HClO). Khi hòa Javen (Natri hypochlorite) trong nước, nó cũng bị phân hủy thành ion natri và clorua. Nếu hòa NaClO thì nó sẽ bị phân hủy thành natri clorua và oxy.
Phản ứng của Javen (Natri hypochlorite) với axit oxalic:
H₂C₂O₄ + NaClO → NaCl + 2CO₂ + H₂O
Phản ứng của Javen (Natri hypochlorite) với axit HCl:
NaClO + 2HCl → NaCl + Cl₂ + H2O
Nước tẩy javen phản ứng với dung dịch H2SO4:
H2SO4 + 2NaClO → Na₂SO4 + 2HclO
NaClO phản ứng với nước oxy già:
2H2O2 + NaClO → NaClO3 + 2H2O
Javen (Natri hypochlorite) phản ứng với khí CO2 + H2O:
H2O + NaClO + CO2 → NaHCO3 + HClO
Natri hypochlorite phản ứng với NaOH:
NaClO + 2NaOH + 2NH2Cl → 3H2O + N2 + 3NaCl
NaClO phản ứng với kali iốt:
H2O + 2KI + NaClO → I2 + 2KOH + NaCl
Javen phản ứng với dung dịch đệm PbS:
4NaClO + PbS → 4NaCl + PbSO4
Javen (Natri hypochlorite) phản ứng với các kim loại hoạt động mạnh:
NaClO + Zn → ZnO + NaCl
Điều chế nước javen trong phòng thí nghiệm
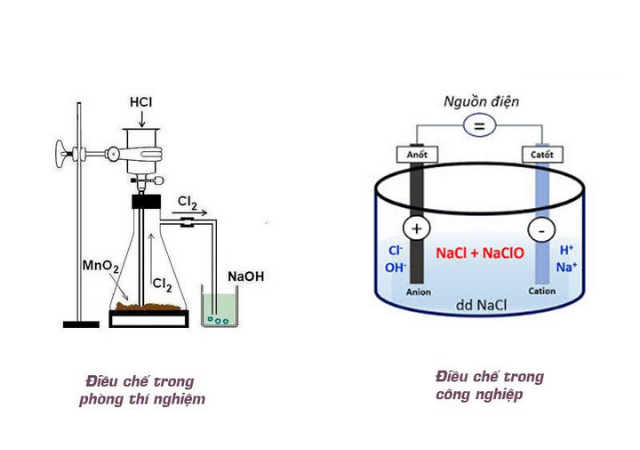
Cách điều chế Javen (NaClO)
Javen (NaClO) có thể được điều chế trong phòng thí nghiệm từ những chất sẵn có. Quá trình điều chế nước javen trong phòng thí nghiệm được mô tả như sau:
Cách 1: Điều chế Javen (NaClO) từ khí Cl2 và dung dịch NaOH
Điều chế nước javen trong phòng thí nghiệm chúng ta có thể dùng khí Cl2 và dung dịch NaOH. Đầu tiên, chúng ta tiến hành cho khí Clo đi qua dung dịch NaOH ở nhiệt độ thường. Dung dịch NaOH tạo ra bằng cách cho Na vào H2O. Khi phản ứng xảy ra chúng ta sẽ thu được một dung dịch có chứa cả NaCl và NaClO, gọi chung là Javen.
Phương trình: Cl2 + 2NaOH -> NaCl + NaClO + H2O
Cách 2: Điều chế Javen (NaClO) từ MnO2 và dung dịch HCl
Chúng ta có thể điều chế nước javen trong phòng thí nghiệm từ MnO2 và dung dịch HCl. Đầu tiên chúng ta sẽ cho MnO2 phản ứng với axit HCl để tạo ra khí clo. Dẫn khí Clo sục qua bể chứa NaOH và thu được dung dịch Javen (NaClO).
Phương trình:
4HCl + MnO2 → Cl2 + 2H2O + MnCl2
Cl2 + 2NaOH → NaCl + NaClO + H2O
Ngoài 2 cách điều chế Javen (NaClO) trong phòng thí nghiệm trên thì để tiết kiệm chi phí, sản xuất được lượng lớn nước Javen, người ta sẽ sử dụng đến cách điều chế Javen (NaClO) trong công nghiệp.
Phương pháp điều chế Javen (NaClO) trong công nghiệp được mô tả:
Giai đoạn 1: Điện phân dung dịch muối NaCl thành chất xút NaOH và H2 theo phương trình:
2NaCl + 2H2O -> 2NaOH + H2 + Cl2
Giai đoạn 2: Loại bỏ khí Hidro thoát ra ở một điện cực, thu lại khí Clo. Tiếp tục cho phản ứng lại với dung dịch NaOH để thu về Javen (NaClO):
Phương trình:
Cl2 + 2NaOH -> NaCl + NaClO + H2O
||Xem thêm: Kim Loại Là Gì? Tính Chất Hóa Học Chung Của Kim Loại
Ứng dụng của nước Javen trong thực tế

Javen (NaClO) có tính ứng dụng rất cao trong thực tế
Nước gia ven có tính chất oxy hóa cao, vì thế nó được sản xuất và ứng dụng trong rất nhiều lĩnh vực của cuộc sống. Cụ thể:
Dùng để khử trùng
Javen được sử dụng để khử trùng nước tại các bể bơi nhằm loại bỏ các vi khuẩn gây hại còn tồn tại ở trong nước. Sử dụng để khử khuẩn nguồn nước tại những nơi vừa bị thiên tai bão lũ. Khử khuẩn và làm sạch các khu vực vệ sinh.
Loại bỏ các vết bẩn cứng đầu
Nhờ có tính oxy hóa mạnh, chúng ta sử dụng Javen để tẩy bỏ các vết bẩn như: cafe, trà, nước tương,…trên vải. Vết bẩn sau khi tiếp xúc với Javen sẽ được loại bỏ hoàn toàn.
Các thông tin trên đã cung cấp đầy đủ cho bạn đọc thông tin về Javen, cách điều chế nước javen trong phòng thí nghiệm. Đây là một dạng hợp chất có tính ứng dụng cao trong thực tế và xuất hiện nhiều trong các dạng bài tập hóa học đó.
||Bài viết liên quan khác:
- Điều Chế SO2 Trong Phòng Thí Nghiệm | Sơ đồ, phản ứng
- Điều Chế Clo Trong Phòng Thí Nghiệm | Phương trình, sơ đồ
- Điều Chế Oxi Trong Phòng Thí Nghiệm | Phương trình, sơ đồ
- Cách điều chế Hidro trong phòng thí nghiệm, Phương trình