Benzen là gì? Benzen có làm mất màu dung dịch Brom không? Đây là một trong những câu hỏi được rất nhiều bạn học sinh thắc mắc. Để trả lời được câu hỏi này, hãy cùng Kiến thức Tổng hợp đi tìm hiểu bài viết dưới đây nhé!
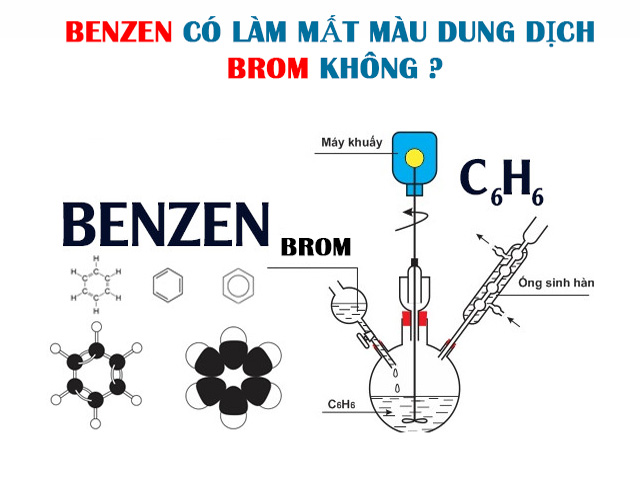
Hóa học – Benzen có làm mất màu dung dịch Brom không?
Nội dung bài viết
Benzen có làm mất màu dung dịch Brom không?
Benzen có làm mất màu dung dịch Brom không? – Câu trả lời là KHÔNG. Bởi Benzen là phân tử có cấu tạo vòng, trong đó có 3 liên kết đôi xen kẽ 3 liên kết đơn. Những liên kết này đều là liên kết dễ thế, khó cộng và bền với chất oxy hóa. Vì thế Benzen không tác dụng với dung dịch Brom trong điều kiện thường, nên nó không mà mất màu dung dịch Brom.
Để hiểu rõ hơn tại sao Benzen lại không làm mất màu dung dịch Brom chúng ta cùng đi tìm hiểu rõ hơn về cấu tạo, tính chất của Benzen và Brom dưới đây nhé!
Benzen là chất gì?
Benzen là chất lỏng không màu và cũng không tan trong nước. Khối lượng riêng của Benzen nhẹ hơn nước và chất này có thể hòa tan được nhiều chất khác như dầu ăn, nến, iot, cao su,… Benzen có mùi thơm nhẹ, nhưng nó rất hại đối với sức khỏe con người. Công thức phân tử của Benzen là C6H6.
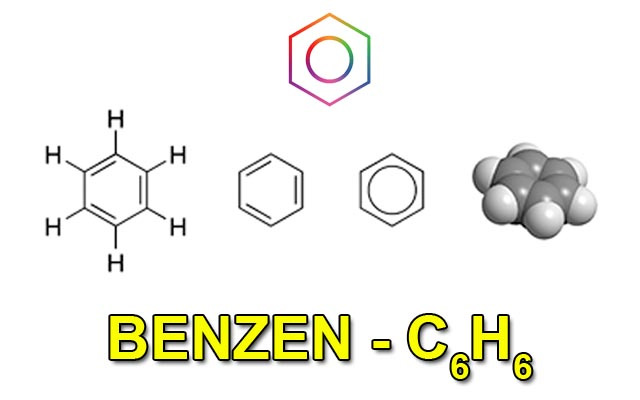
Benzen là chất lỏng không màu và cũng không tan trong nước
Cấu tạo của Benzen
Phân tử Benzen gồm 6 nguyên tử C và 6 nguyên tử H nằm trong cùng 1 mặt phẳng. Trong đó, 6 nguyên tử C tạo thành hình lục giác đều và mỗi nguyên tử C lại liên kết với 1 nguyên tử H.
Độ dài của các liên kết C – C bằng nhau, và độ dài các liên kết C-H cũng như nhau. 3 liên kết Pi này ở vị trí liên hợp làm cho vòng benzen khá bền. Dễ thế, khó cộng và bền với chất oxy hóa là tính chất chung của Benzen.
Tính chất hóa học của Benzen
*Phản ứng thế
Với phản ứng thế, benzen chỉ tham gia thế ở nguyên tử H ở mạch vòng, còn những đồng đẳng của Benzen thì sẽ tham gia thêm phản ứng thế nguyên tử H ở mạch nhánh.
C6H6 + Br2 → C6H5Br + HBr (Fe, tº)
C6H6 + HNO3 → C6H5NO2 + H2O (H2SO4 đặc, tº)
Do ảnh hưởng của nhân thơm đối với mạch nhánh, nên khi chiếu sáng Toluen tham gia phản ứng thế nguyên tử Hidro ở nhóm CH3.
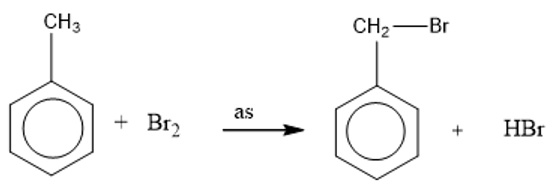
Toluen tham gia phản ứng Brom ở vòng dễ dàng hơn và tạo thành hỗn hợp 2 đồng phân khi có xúc tác là bột sắt.
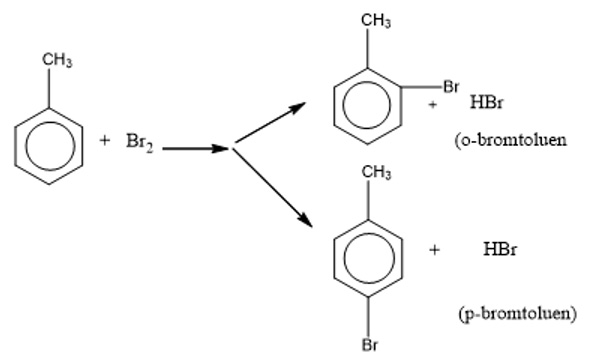
Quy tắc thế vòng Benzen:
- Nếu trong vòng Benzen đã có sẵn nhóm Ankyl hoặc những nhóm -OCH3, -NH2, -OH,… thì phản ứng thế vào vòng đó rất dễ xảy ra, nó thường ưu tiên xảy ra ở vị trí nhóm para và ortho.
- Nếu trong vòng Benzen có sẵn nhóm -NO2 hoặc nhóm -SO3H, -COOH,… thì phản ứng thế vào vòng đó sẽ khó hơn nhiều. Đồng thời, chúng cũng ưu tiên xảy ra ở vị trí meta.
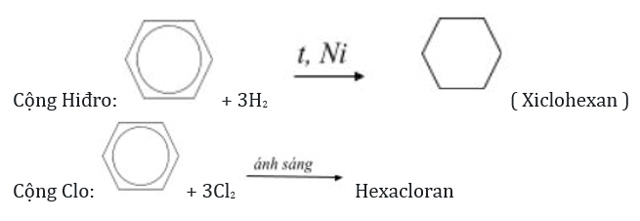
*Phản ứng cộng
Do phân tử Benzen có cấu tạo đặc biệt, vì thế mà chúng vừa có phản ứng cộng, vừa có phản ứng thế. Tuy nhiên, phản ứng cộng của Benzen sẽ khó xảy ra hơn so với axetilen và etilen.
Benzen tham gia phản ứng cộng với Clo và Hidro trong các điều kiện phản ứng khác nhau.
*Phản ứng oxy hóa
Benzen không thể tác dụng được với dung dịch KMnO4, nên chúng không làm mất màu dung dịch KMnO4 được. Ngoài ra, Benzen cũng rất dễ cháy và tạo ra khí cacbon đioxit và hơi nước. Phương trình phản ứng như sau:
C6H6 + O2 → 6CO2 + 3H2O
Riêng trong trường hợp Benzen cháy trong không khí thì chúng có thể tạo ra muội than.
Điều chế Benzen
Hiện nay, cách phổ biến nhất để điều chế Benzen đó chính là chưng cất nhựa than đá và dầu mỏ. Bên cạnh đó, chúng cũng được điều chế từ xicloankan hoặc ankan. Công thức điều chế như sau:
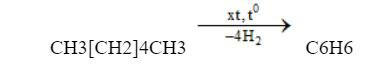
Ứng dụng của benzen
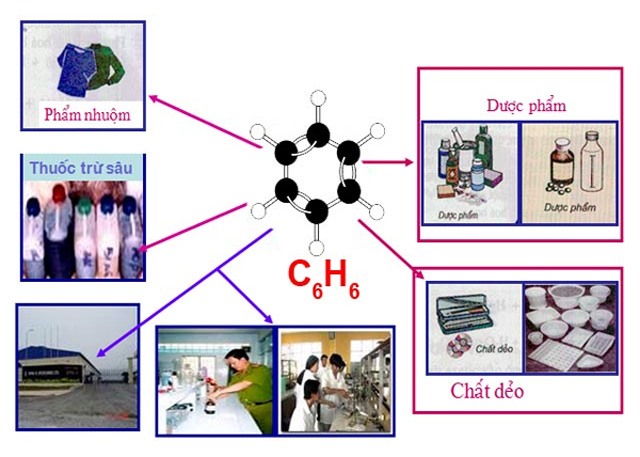
Benzen được ứng dụng rất nhiều trong ngành công nghiệp, đặc biệt là hóa hữu cơ
Ngày nay, Benzen được sử dụng phổ biến, đặc biệt là ngành công nghiệp hóa hữu cơ. Chúng được sử dụng để tổng hợp các monome trong sản xuất polime làm cao su, chất dẻo, tơ sợi,… Hoặc được sử dụng để tẩy mỡ ở xương, vải, da sợi, tẩy mỡ các tấm kim loại.
Benzen được sử dụng để điều chế ra các chất khác. Chẳng hạn như điều chế ra phenol, nitrobenzen, anilin, dược phẩm, thuốc nhuộm, thuốc trừ dịch hại, axeton,…
||Xem thêm: Chất không có khả năng làm xanh nước quỳ tím là chất nào?
Brom là chất gì?
Brom có ký hiệu hóa học là Br và nó thuộc nhóm Halogen. Đây là chất lỏng bốc khói màu nâu đỏ ở nhiệt độ phòng. Và nó có thể dễ dàng bốc hơi để hình thành chất khí có màu tương tự.
Ở trạng thái tự nhiên, Brom tồn tại ở dạng hợp chất, chủ yếu là muối Bromua của Natri, Kali, Magie. Và Bromua kim loại có trong nước biển, nước của 1 số hồ cùng với muối clorua.

Brom là chất lỏng có màu nâu đỏ ở nhiệt độ phòng
Tính chất vật lý của Brom:
- Là chất lỏng màu đỏ nâu, dễ bay hơi và có mùi độc, khó chịu
- Nhiệt độ nóng chảy: 265.8K và nhiệt độ sôi là 332,0K
- Brom ít tan trong nước, nhưng nó lại tan nhiều trong các dung môi hữu cơ như xăng, etanol, benzen,…
Tính chất hóa học của Brom
- Tác dụng với kim loại: Sản phẩm tạo ra là muối tương ứng
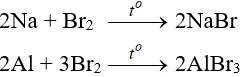
- Tác dụng với Hidro:
![]()
Độ hoạt động sẽ giảm dần từ Cl → Br → I
Các khí HI, HBr tan vào nước tạo dung dịch axit.
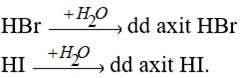
Còn độ mạnh của axit lại tăng dần từ HCl < HBr < HI.
- Tính khử của HBr, Br2:
Brom thể hiện tính khử khi gặp chất oxy hóa mạnh như nước clo,….
Br2 + 5Cl2 + 6H2O → 10HCl + 2HBrO3 (Axit bromic)
Tính khử của HBr ở trạng thái khí cũng như trong dung dịch đều mạnh hơn HCl. HBr có thể khử được H2SO4 đặc thành SO2:
2 HBr + H2SO4 đặc → Br2 + SO2 + 2H2O
Dung dịch HBr không màu và để lâu trong không khí sẽ trở nên sẽ có màu vàng nâu, bởi nó bị oxi hóa (những dung dịch HCl và HF đều không có phản ứng này).
4HBr + O2 → 2H2O + 2Br2
Điều chế Brom
Nguồn nguyên liệu chính để điều chế Brom chính là nước biển. Lúc này, chúng ta sẽ điều chế Brom dựa trên sự oxi hóa ion Br- và chất oxi hóa là Clo.
![]()
Một số hợp chất của Brom
- Hidro Bromua
Ở nhiệt độ thường thì HBr ở dạng chất khí, không màu và bốc khói trong không khí ẩm và rất dễ tan trong nước. Và HBr trong nước được gọi chung là dung dịch axit bromhidric. Đây là loại axit mạnh và có tính khử mạnh hơn cả axit clohidric. Và HBr có thể khử được H2SO4 đặc thành SO2.
![]()
- Hợp chất chứa oxi của Br
Axit bromic (HBrO3), Axit pebromic (HBrO4), Axit Hipobromo (HBrO) có tính bền, tính axit và tính oxi hóa kém hơn HClO.
![]()
Ứng dụng của Brom

Brom được ứng dụng rộng rãi trong sản xuất nông nghiệp và công nghiệp
Ngày nay, Brom được ứng dụng rộng rãi trong dược phẩm, sản xuất thuốc nhuộm, mực in, hoặc trong nhiếp ảnh để làm thuốc tráng hình. Nó được sử dụng như 1 chất chống cháy có khả năng làm chất ngăn chặn hoặc làm chậm quá trình phát lửa do chất dẻo.
- Trong nông nghiệp: Các hợp chất Brom hữu cơ là nguyên liệu để tạo ra thuốc trừ sinh vật gây hại, diệt sâu bọ hoặc những loài gặm nhấm
- Trong công nghiệp: Sử dụng làm chất phụ gia xăng dầu. Tuy nhiên, ứng dụng này ngày dần ít đi. Hoặc ứng dụng trong khoan dầu: hợp chất bromua dạng lỏng được sử dụng làm dung dịch khoan đặc biệt cho giếng khoan sâu và có áp suất cao.
Trên đây là những thông tin chia sẻ về cầu hỏi “Benzen là gì? Benzen có làm mất màu dung dịch Brom không?”. Chúc các bạn có buổi học vui vẻ và hiệu quả, và nếu có bất cứ thắc mắc gì, hãy comment dưới bài viết này chúng tôi sẽ giải đáp giúp bạn nhé!
||Bài viết liên quan khác:
- Điều Chế Metan Trong Phòng Thí Nghiệm | Phương trình (CH4)
- Khí Nito Là Gì? Điều Chế N2 Trong Phòng Thí Nghiệm
- Các Chất Lưỡng Tính Thường Gặp Trong Hoá Học Và Dạng Bài Tập
- Cách điều chế CO trong phòng thí nghiệm chuẩn nhất